摘 要:如何有效治疗牙周炎并实现受损牙周骨组织再生,一直是牙周疾病治疗中具有挑战性的问题,而矿化是牙周正常发育和功能中关键因素之一。本研究旨在探讨硅酸钙锂(Li2Ca2Si2O7)生物陶瓷对人牙周膜成纤维细胞增殖、矿化的影响及用于牙周骨组织再生的可能性。采用溶胶-凝胶法制备合成了 Li2Ca2Si2O7 陶瓷粉体。通过体外模拟体液浸泡,发现 Li2Ca2Si2O7 粉体具有良好的羟基磷灰石矿化能力。生物学结果表明:Li2Ca2Si2O7 粉体的浸提液在 3.125~25 mg/mL 浓度范围内能显著促进HPLFs 的增殖,低浓度(6.25 mg/mL)时可显著诱导 HPLFs 细胞体外矿化(p<0.05)。Li2Ca2Si2O7 粉体具有促进人牙周膜成纤维细胞增殖和矿化能力,可望作为牙周骨组织再生修复的生物活性材料。
关 键 词: Li2Ca2Si2O7 生物陶瓷;人牙周膜成纤维细胞;增殖;矿化
牙周炎是一种由局部因素引起的牙周支持组织的慢性炎症,会导致牙周骨组织潜行性破坏[1]。对牙周炎患者的最终治疗目标之一就是恢复和重建丧失的牙周骨组织。目前常用的牙周组织修复治疗技术如根面处理翻瓣术、引导性牙周组织再生术、牙周植骨术等均未能实现牙周骨组织再生[2]。研究发现,生长因子的使用可调节牙周种子细胞的增殖分化和细胞外基质的生物合成,促进牙周组织的再生和修复[3]。但外源性生长因子存在半衰期短、体内代谢快、费用昂贵等缺点,在临床应用上受到一定的限制[4]。随着再生医学、干细胞生物学和生物材料学研究的不断发展,越来越多的生物材料被开发和应用于牙周骨组织修复再生的研究中。羟基磷灰石(hydroxyapatite, HA)因其无机成分与人骨骼相同,具有良好的生物相容性,被广泛应用于牙周组织工程。Figliuzzi 等[5]运用 HA 填补牙周炎患者牙槽骨缺损,手术后牙槽骨有明显修复,但其存在塑形性差、强度低以及降解速率慢等缺点。HA/磷酸三钙双相陶瓷材料的生物性能和降解速率较单相材料有明显改善,然而其刺激相关细胞增殖和诱导细胞分化的能力却仍不能满足要求[6]。
硅酸盐生物陶瓷作为一类新型的生物材料,因其良好的降解性与骨诱导性近年来也被广泛应用于骨和牙组织修复领域[7-8]。已有多种硅酸盐陶瓷材料(如 Ca3ZrSi2O9陶瓷、镁黄长石 Ca2MgSi2O7、白硅钙
石 Ca7MgSi4O16、透辉石 CaMgSi2O6、叠磷硅钙石Ca7Si2P2O16)被证实能够诱导牙周膜细胞(PDLCs)的成骨/成牙相关基因 (ALP、OCN、CAP、CEMP1、DMP-1, OPN, RUNX2)表达和蛋白合成[9-13]。研究认为 硅 基 陶 瓷 中 释 放 的 Si 离 子 是 通 过 激 活Wnt/β-catenin 信号通路促进成骨(ALP、OCN)和成牙(CEMP1、CAP)分化相关重要基因表达的,从而促进牙骨质和牙槽骨的再生。Si 离子在促进 PDLCs的成骨/成牙分化过程中发挥着关键作用,其他离子如 Mg、Zr、P 等起协同作用[8]。同时,这些硅酸盐陶瓷材料均具有良好的生物矿化性能,ALP、OCN均为与矿化有关的重要基因,说明生物矿化对于牙周骨组织再生十分重要。
锂(Li)曾被广泛用作治疗抑郁症的长期心境稳定剂[14]。有研究表明,适宜浓度的 Li 离子可以通过抑 制 Wnt/ -catenin 中GSK-3β 的降解 以激活Wnt/ -catenin信号通路,从而促进牙周膜细胞/骨髓间充质干细胞的增殖和成骨/成牙骨质分化[15-18]。同时,特定浓度的 Li 离子能够在抑制巨噬细胞促炎因子(TNF-α、IL-6 和 IL-18 等)表达的同时,显著提高巨噬细胞抗炎因子表达,并且促进巨噬细胞向M2 表型分化,通过 NF-kB 信号通路显著抑制巨噬细胞的破骨分化,减少骨吸收[19-20]。因此,本研究认为锂的生物学作用有可能在抑制牙周组织免疫炎症反应、阻止牙周组织破坏和促进牙槽骨新生中发挥重要作用。
牙周膜成纤维细胞(Periodontal Ligament Fibro blasts,PLFs)是牙周组织中数量最多、功能最活跃的细胞,能不断地形成新的牙周纤维和牙骨质,直接参与牙槽骨的改建。一旦牙周膜成纤维细胞在数量上减少或结构破坏,可能导致牙周支持组织的损害,进一步诱发并加重牙周组织疾病的发生[21]。因此,牙周膜成纤维细胞的增殖、分化活性对于牙周组织再生至关重要。矿化也是牙周结构正常发育和功能中的关键因素之一。矿化缺失会导致牙列软脆,使牙齿易于感染、过早脱落[22-23]。
因此,基于硅和锂离子对牙/骨组织修复的积极作用,本研究拟通过合成新型锂硅酸钙生物陶瓷(Li2Ca2Si2O7),研究该材料释放出的离子产物对人牙周膜成纤维细胞(Human Periodontal Ligament Fibroblasts,HPLFs)增殖和矿化的影响,希望能为牙周骨组织再生研制出新的生物材料。
1 实验方法
1.1 Li2Ca2Si2O7 粉体制备和表征
Li2Ca2Si2O7粉体采用溶胶凝胶法制备。首先在室温下将正硅酸乙酯((C2H5O)4Si, TEOS)、去离子水和2mol/L 的硝酸按摩尔比1:8:0.08 混合搅拌6h 完全水解。Li,Ca,Si 按照化学计量比 2:2:2,依次加入硝酸锂(LiNO3)和硝酸钙(Ca(NO3)2·4H2O),搅拌5h得到澄清溶液。然后将制得的澄清溶液密封在60 ℃烘箱中陈化24h,并在120 ℃干燥48 h,得到干凝胶;将干凝胶球磨3h后过孔径75µm 的筛,在850 ℃煅烧2h,自然冷却,得到Li2Ca2Si2O7生物活性陶瓷粉体。采用 X 射线衍射仪 (D/max 2550 V,Rigaku, 日本) 对制备的粉体进行物相鉴定。采用扫描电子显微镜 (Scanning Electron Microscopy ,SU8220, 日本) 观察粉体的颗粒大小及形貎。采用激光粒度仪(Bettersize2600)对粉体粒径进行检测。
1.2 Li2Ca2Si2O7 粉体体外矿化性能研究
将粉体作模拟体液 (Simulated Body Fluid,SBF)浸泡实验,以研究粉体在 SBF 中诱导类骨磷灰石形成的能力。首先将粉体置于 50 mL 聚丙烯离心管中,按照粉体质量和 SBF 体积比为 1.5 mg:1 mL(1.5
mg/mL)的比例,加入 SBF 溶液,加盖密封,置于37 ℃恒温水浴摇床内以 120 r/min 的速度震荡。1、3、7、10、14 d 后换液,收集换下的 SBF 用于分析粉体矿化过程中的离子产物变化。采用电感耦合等离子发射光谱仪(ICP-AES,715,Varian Co,美国)测定离子浓度。在预定浸泡时间后,过滤出粉体样品,去离子水轻轻洗涤,置于 60 ℃烘箱中干燥。经 SBF 浸泡后的粉体样品,采用 X 射线衍射仪(X Ray Diffraction,XRD)分析物相,采用 SEM 观察形貌,并与未经 SBF 浸泡的粉体进行对比。
1.3 生物学研究
1.3.1 细胞培养
HPLFs 细胞(货号#2630)和成纤维细胞培养液(Fibroblast Medium,FM,货号#2301)购自美国ScienCell 公司。HPLFs 用成纤维细胞培养液培养于37 ℃的二氧化碳培养箱中。每天换液,当细胞汇聚到 90%后经 0.25%胰酶消化传代,2~5 代细胞用于后续实验。
1.3.2 Li2Ca2Si2O7 粉体浸提液的制备
Li2Ca2Si2O7 粉体浸泡于无血清成纤维细胞培养液,浓度为200mg/mL。37 ℃浸泡24h,4000 r/min离心10 min,收集上清液。上清液经0.22μm 一次性滤器过滤后,补加10%胎牛血清。用含血清的成纤维细胞培养液将200 mg/mL的Li2Ca2Si2O7粉体浸提液逐级稀释到100、50、25、12.5、6.25、3.125mg/mL。含血清的成纤维细胞培养液作为空白对照。采用电感耦合等离子发射光谱仪(ICP-AES,715,Varian Co,美国)测定 Li2Ca2Si2O7粉体浸提液中离子浓度。
1.3.3 细胞增殖活性
HPLFs 培养于96孔板中,每孔5000个细胞。细胞贴壁后,换成不同浓度的Li2Ca2Si2O7 粉体浸提液,继续培养1、3、7 d。在相应的检测时间点,每孔加100μL 0.5 mg/mL 的甲瓚(MTT)溶液,37 ℃孵育 2h。去掉培养液后,每孔加100μL 二甲基亚砜反复吹吸数次,采用酶标仪(Spark,Tecan,瑞士)检测其450nm 处的吸光度值,并进行统计分析。该实验重复3次。
1.3.4 茜素红染色
茜素红染色用于检测细胞的成骨矿化活性。HPLFs 培养于96孔板中,每孔5000个细胞。待细胞贴壁后,换成不同浓度的Li2Ca2Si2O7粉体浸提液,补加50μg/mL 的抗坏血酸、10mmol/L 的β甘油磷酸二钠盐、继续培养14d。细胞用PBS洗3次,70%的乙醇固定15min。细胞用去离子水洗3次,1%的茜素红常温孵育60min,去掉茜素红染液,去离子水洗3次。矿化结节被染成红色,倒置显微镜(DM i8,Leica,德国)下拍照。加入10%的氯化十六烷基吡啶洗脱,洗脱液在酶标仪(Spark,Tecan,瑞士)550 nm 下检测吸光度值,并进行定量分析。该实验重复3次。
1.3.5 细胞骨架染色
细胞骨架染色用于评价细胞形态和黏附状态。无菌细胞爬片置于24孔板中,每孔接种HPLFs2×104 个 。待细胞贴壁后 , 换成不同浓度的Li2Ca2Si2O7粉体浸提液,继续培养24 h。细胞用PBS洗3次,加 4%的多聚甲醛固定 20 min。Alexa Fluor 594-偶联的鬼笔环肽(Molecular Probes,美国)孵育20 min,PBS 洗 3 次,细胞核燃料 DAPI(Sigma,德国)孵育5min,PBS 洗3次。激光共聚焦显微镜(SP8,Leica,德国)下拍照。
1.4 统计分析
采用 SPSS 22.0 软件进行统计学分析,计量资料用均数±标准差( X ± s) 表达,组间比较采用单因素方差分析,P<0.05 为差异有统计学意义。
2 结果与讨论
2.1 Li2Ca2Si2O7 粉体性能表征及矿化能力
图 1 为溶胶凝胶法制备的 Li2Ca2Si2O7 粉体的XRD 图谱、SEM 形貌和粒径分布情况。XRD 结果显示,干凝胶在850oC 煅烧2h获得的产物衍射峰均为Li2Ca2Si2O7 特征峰,衍射峰的位置和相对强度均和标准卡片JCPD 31-0712 一致,并且峰形尖锐,表明产物为结晶性良好的纯相 Li2Ca2Si2O7 粉体(图1A)。粉体 SEM 照片显示获得的 Li2Ca2Si2O7 粉体颗粒呈不规则形状,大小分布不均匀,部分发生了团聚 (图 1B),粒径分布图显示其颗粒粒径大小约为10~45 μm (图 1C)。

图 1 Li2Ca2Si2O7 粉体 XRD 图谱(A)、SEM 形貌(B)和粒径分布(C)
图 2 为 Li2Ca2Si2O7 粉体在模拟体液中浸泡 1、3、7、14 d 后的 XRD 图谱。从图中可以看出,浸泡 3 d后,Li2Ca2Si2O7 特征峰消失,在 2θ=31.7°出现了 HA的特征峰(JCPD 09-0432)。随着浸泡时间延长,HA的特征峰更加明显,这是由于随着 SBF 浸泡时间的增加,Li2Ca2Si2O7 粉体表面沉积的 HA 逐渐增加,表明其具有良好的体外矿化能力。
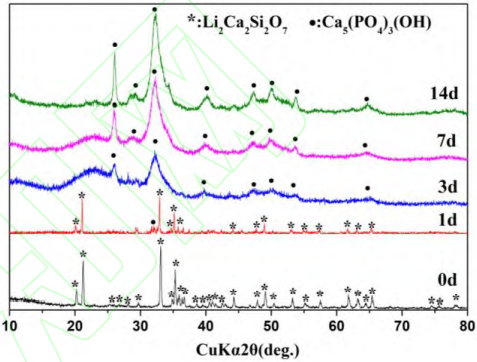
图 2 Li2Ca2Si2O7 粉体浸泡 SBF 不同时间后 XRD 图谱
图 3 为 Li2Ca2Si2O7 粉体在 SBF 浸泡 1、3、7、14 d 后的 SEM 照片。在 SBF 浸泡之前,Li2Ca2Si2O7粉体表面较光滑,无明显颗粒沉积(图 3A); 在 SBF中浸泡1和3 d后,Li2Ca2Si2O7粉体的表面变得粗糙,开始沉积一些纳米颗粒(图 3B、C)。随着浸泡时间的增加,Li2Ca2Si2O7 粉体表面形成了 HA 团簇(图3D、E),这与 XRD 分析中 7 和 14 d 浸泡后 HA的特征峰更显著一致。更高放大倍数的照片显示,表面形成的 HA 晶粒呈片状结构,大小均匀,形态较为一致(图 3F)。

图 3 Li2Ca2Si2O7 粉体浸泡 SBF 不同时间后 SEM 照片
2.2 Li2Ca2Si2O7 粉体浸泡 SBF 溶液离子浓度变化
图4为 Li2Ca2Si2O7粉体在浸泡不同时间时的离子浓度变化。从图中可以看出,浸泡第1d,Si离子开始大量溶出,随着浸泡时间延长,离子释放速度逐渐减慢并保持缓释;Li离子经过1d浸泡后也大量溶出,第3d时溶出明显减缓;Ca 离子在浸泡第1d大量释放,在第3d大幅下降后逐渐稳定,SBF溶液中P离子浓度在第1d大幅下降,表明P离子被快速消耗。前期的硅酸盐陶瓷在 SBF 中矿化机理研究表明,在浸泡过程中,硅酸盐陶瓷先释放出Ca离子,并与SBF中的H离子交换,在材料的表面形成Si–OH层[7,24]。由于Si–OH层带有负电荷, 吸引溶液中带正电的Ca离子, 并形成无定形的Ca–Si层, 从而带正电荷。带正电荷的Ca–Si层再吸引溶液中带负电荷的HPO42-离子形成无定形Ca–P化合物, 随之成 核 、结晶并生长成 HA[7,24] 。在本实验中 ,Li2Ca2Si2O7粉体浸泡第1d,Ca、Si、Li 离子均大量释放,Si离子可形成富Si层为HA提供成核位点,有利于HA逐渐形成[25]。由于Ca-P沉积层出现,部分沉积晶体会逐渐包裹Li2Ca2Si2O7粉体颗粒,从而导致Si和Li离子释放速度减慢,其中Li离子更为明显,推测可能是释出的Li离子协同参与了Ca-P沉积,使得浸泡液中Li离子部分被消耗,也可能是Li离子比较容易突释。从浸泡第3d开始,几种离子释放速度均减缓并趋于稳定,提示HA晶体逐渐形成,这也证明了上述 XRD 分析和 SEM 图谱结果。
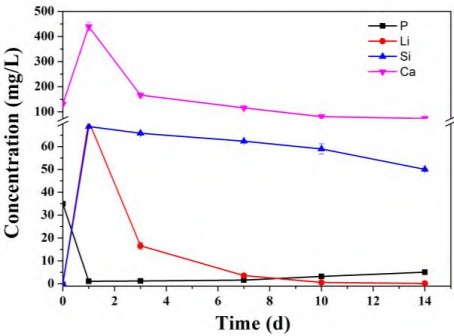
图 4. Li2Ca2Si2O7粉体浸泡 SBF 不同时间点各离子浓度
2.3 Li2Ca2Si2O7粉体浸提液对 HPLFs 增殖影响
通过将HPLFS分别培养于不同浓度的Li2Ca2Si2O7粉体浸提液中,研究浸提液对HPLFs增殖的影响。经过MTT增殖实验,与空白对照相比,3.125、6.25、12.5以及25 mg/mL 粉体浸提液均能促进HPLFs增殖(p<0.05);而 100 mg/mL 以及 200mg/mL 高浓度的粉体浸提液则会显著抑制HPLFs的增殖(图 5)。这与不同浓度粉体浸提液中的各种离子浓度密切相关。
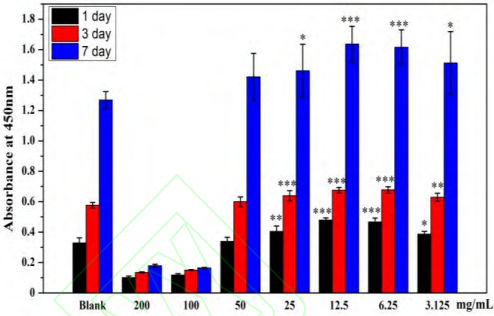
图 5. Li2Ca2Si2O7粉体浸提液诱导 HPLFs 细胞增殖
表1为不同浓度Li2Ca2Si2O7粉体浸提液中的各种离子浓度。从表中可以看出浸提液原液中(200mg/mL)Ca、P 离子显著低于空白培养液,这可能是由于高浓度粉体浸提液的高 pH 值以及释放出的 Ca
离子过饱和,并在粉体表面形成 Ca-P 沉积而导致。这 种 现 象 与 前 期 报 道 的 多 种 硅 酸 盐 陶 瓷 ( 如Ca2Mg2Si2O7 、 Ca7Mg2Si4O16 、 CaMgSi2O6 、Sr2MgSi2O7、 Sr5(PO4)2SiO4 等)以及生物玻璃(如45S5、58S 等)粉体的浸提液浸泡实验结果有同样的规律[10, 26-30]。浸提液原液 (200 mg/mL) 中 Li、Si 离子大量释放且质量浓度相近。Li2Ca2Si2O7粉体在培养液中的释放并没有按照分子式中 1:1 的计量比同比例释放,而是 Li 离子摩尔浓度大于硅离子摩尔浓度 。 这 可 能 与 Li2Ca2Si2O7的 晶 体 结 构 有 关 ,Li2Ca2Si2O7属于六方晶系,由 LiO4和 SiO4 四面体通过角共享连接。Li-O 的键长(0.213 nm)大于 Si-O 的键长(0.163 nm)[31]。Zhang 等[32]通过理论计算表明,锂硅酸盐结构中四面体的Li-O键强度小于Si-O键强度,因此 Li 离子比 Si 离子更容易被释放出来。当使用含血清的成纤维细胞培养液将 200 mg/mL 的Li2Ca2Si2O7粉体浸提液逐级稀释到 100,50,25,12.5,6.25,3.125 mg/mL 时,Li、Si 离子浓度成倍下降,Ca、P 离子浓度趋于空白组培养液。因此,对于低浓度粉体浸提液,更多的是 Li、Si 离子的作用。
表 1. Li2Ca2Si2O7粉体浸提液的离子浓度

在随后的实验中Li2Ca2Si2O7粉体浸提液的最高浓度设定为 50 mg/mL。细胞骨架染色结果与空白对照组相比(图 6A-C),6.25 mg/mL 粉体浸提液培养的HPLFs 的细胞骨架完整,细胞呈现典型的纺锤形(图6D-F)。而 50 mg/mL 粉体浸提液培养的 HPLFs 细胞形态明显拉长,细胞骨架松散(图 6G-I)。细胞骨架染色结果表明,低浓度的Li2Ca2Si2O7粉体浸提液(6.25mg/mL)能够维持 HPLFs 正常的形态,促进细胞粘附。
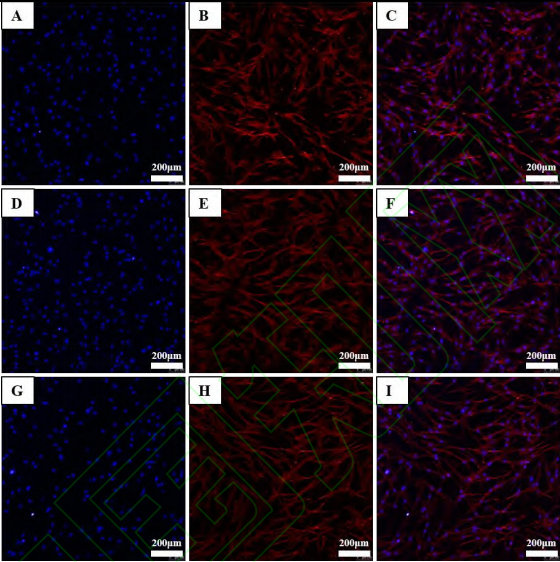
图 6. Li2Ca2Si2O7粉体浸提液诱导 HPLFs 细胞骨架染色照片
2.4 Li2Ca2Si2O7粉体浸提液对 HPLFs 体外矿化影响
与空白组相比,茜素红染色涂片结果显示,6.25 mg/mL 以及50 mg/mL组均可观察到矿化结节,表明Li2Ca2Si2O7粉体浸提液能够显著促进 HPLFs体外矿化(p<0.05)。低浓度的Li2Ca2Si2O7粉体浸提液(6.25 mg/mL)诱导产生的矿化结节显著多于高浓度的浸提液(50 mg/mL)(图 7)。
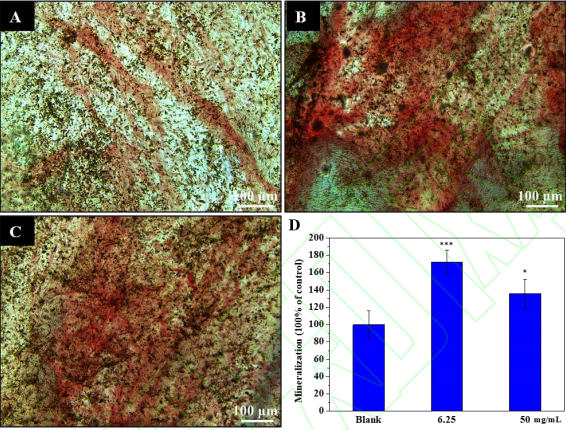
图 7. Li2Ca2Si2O7粉体浸提液诱导 HPLFs 细胞茜素红染色图
牙周组织修复是一个复杂的过程,包括因炎症破坏吸收的硬组织(牙槽骨与牙骨质)和软组织(牙周膜)的重建,即牙周组织再生要求牙槽骨、牙骨质的形成及牙槽骨与牙骨质之间有 HPLFs 的插入[33]。理
想的牙周组织再生生物材料应该具有以下特点:良好的生物相容性、降解性、矿化能力和诱导成骨/成牙分化能力。本实验结果显示,Li2Ca2Si2O7粉体不仅具有良好的体外矿化性能,其低浓度的粉体浸
提液能够促进 HPLFs 细胞增殖、粘附和矿化结节的形成。对于高浓度的粉体浸提液,在促进细胞增殖、粘附和体外矿化方面存在一定程度的抑制作用。这主要是因为 Li、Si 离子含量过高而导致细胞毒性。有研究表明,SiO44-在硅基生物陶瓷诱导矿化过程中起关键作用[34]。Li2Ca2Si2O7粉体在模拟体液浸泡过程中释放的大量 SiO44-可以形成富硅层,为矿化过程提供成核位点,从而加速了矿化。Han 等[18]发现将 5%Li 离子加入介孔生物活性玻璃中(Li、Si 离子浓度范围分别为 8.52~16.01 mg/L 和 79.38~109.99mg/L)时,可显著促进 HPLFs 增殖,显著增强其ALP、OPN 和 OCN 的矿化相关基因表达。本研究中低浓度(3.125~12.5 mg/mL)的Li2Ca2Si2O7粉体浸提液释放的 Li、Si 离子浓度范围分别是 13.45~53.42mg/L 和 13.62~51.57 mg/L,也具有相似的浓度范围。因此,我们推测低浓度的 Li2Ca2Si2O7粉体浸提液也可能通过激活 Wnt/β-catenin 信号通路促进成骨和成牙分化,从而促进牙骨质和牙槽骨的再生。在我们的前期研究中发现,50 mg/L Li 离子和 33 mg/L Si离子可能具有抑制破骨细胞分化的协同作用[19]。因此,本研究推测低浓度 (3.125~12.5 mg/mL) 的Li2Ca2Si2O7粉体浸提液可能在抑制牙周骨组织免疫炎症反应、阻止牙周骨组织破坏和促进牙槽骨新生中发挥作用。Li2Ca2Si2O7粉体可能成为牙周骨组织再生应用的一种有前景的生物活性材料。
3 结论
本研究采用溶胶-凝胶法合成了Li2Ca2Si2O7陶瓷粉体,其在模拟体液中显示出良好的羟基磷灰石矿化能力。
Li2Ca2Si2O7粉体具有离子释放性能,粉体浸提液原液中 Ca、P 离子浓度显著低于空白培养液,而Li、Si 离子浓度显著高于空白培养液,且 Li 离子比Si 离子更容易释放。
低浓度(3.125~12.5 mg/mL)的Li2Ca2Si2O7粉体浸提液中,离子产物对人牙周膜成纤维细胞有显著的增殖和矿化促进作用,而高浓度的粉体浸提液则显著抑制人牙周膜成纤维细胞的增殖,这与不同浓度粉体浸提液中的各种离子浓度密切相关。
综上,Li2Ca2Si2O7陶瓷在牙周骨组织再生方面具有潜在的应用前景。
参考文献
[1] JEPSEN S, CATON JG, ALBANDAR JM, et al. Periodontal manifestations of systemic diseases and developmental and acquired conditions: consensus report of workgroup 3 of the 2017 world workshop on the classification of periodontal and peri-implant diseases and condi tions. Journal of Clinical Periodontology, 2018, 45(Suppl 20): S219-S229.
[2] CHEN FM, JIN Y. Periodontal tissue engineering and regeneration: current approaches and expanding opportunities. Tissue Engineering Part B-Reviews, 2010, 16(2): 219-255.
[3] NAKASHIMA M, REDDI AH. The application of bone morphogenetic proteins to dental tissue engineering. Nature Biotechnology, 2003, 21: 1025- 1032.
[4] CHEN FM, SHELTON RM, JIN Y, et al. Localized delivery of growth factors for periodontal tissue regeneration: role, strategies, and perspectives. Medicinal Research Reviews, 2009, 29: 472-513.
[5] FIGLIUZZI MM, GIUDICE A, PILEGGI S, et al. Biomimetic hydroxyapatite used in the treatment of periodontal intrabony pockets: clinical and radiological analysis. Annali di Stomatologia, 2016, 7(1/2):
16-23.
[6] SHEIKH Z, HAMDAN N, IKEDA Y, et al. Natural graft tissues and synthetic biomaterials for periodontal and alveolar bone reconstructive applications: a review. Biomaterials Research, 2017, 21: 9-1-20.
[7] WU CT, CHANG J. Silicate bioceramics for bone tissue regeneration. Journal of Inorganic Materials, 2013,28(1): 29-39.
[8] ZHOU YH, WU CT, XIAO Y. Silicate-based bioceramics for periodontal regeneration. Journal of Materials Chemistry B, 2014, 2:3907-3910.
[9] ZHANG XF, HAN PP, JAIPRAKASH A, et al. Stimulatory effect of Ca3ZrSi2O9 bioceramics on cementogenic/osteogenic differentiation of periodontal ligament cells. Journal of Materials Chemistry B, 2014,2: 1415–1423.
[10] ZHOU YH, WU CT, ZHANG XF, et al. The ionic products from bredigite bioceramics induced cementogenic differentiation of periodontal ligament cells via activation of Wnt/β-catenin signalling pathway. Journal of Materials Chemistry B, 2013, 1 (27): 3380- 3389.
[11] ZHANG YF, LI S, WU CT. The in vitro and in vivo cementogenesis of CaMgSi2O6 bioceramic scaffolds. Journal of Biomedical Materials Research A, 2014, 102(1): 105-116.
[12] XIA LG, ZHANG ZY, CHEN L, et al. Proliferation and osteogenic differentiation of human periodontalligament cells on akermanite and beta-TCP bioceramics. European Cells & Materials, 2011, 22: 68-83.
[13] ZHOU YH, WU CT, XIAO Y. The stimulation of proliferation and differentiation of periodontal ligament cells by the ionic products from Ca7Si2P2O16 bioceramics. Acta Biomaterialia, 2012, 8(6): 2307-2316.
[14] WILLIAMS RSB, HARWOOD AJ. Lithium therapy and signal transduction. Trends in Pharmacological Sciences, 2000, 21 (2): 61-64.
[15] TANG LJ, CHEN Y, PEI FX, et al. Lithium chloride modulates adipogenesis and osteogenesis of human bone marrow-derived mesenchymal stem cells. Cellular Physiology and Biochemistry, 2015, 37(1):143-152.
[16] HEDGEPETH CM, CONRAD LJ, ZHANG J, et al. Activation of the Wnt signaling pathway: a molecular mechanism for lithium action. Developmental Biology, 1997,185: 82-91.
[17] HAN PP, XU MC, CHANG J, et al. Lithium release from β-tricalcium phosphate inducing cementogenic and osteogenic differentiation for both hPDLCs and hBMSCs. Biomaterials Science, 2014,
2: 1230-1243.
[18] HAN PP, WU CT, CHANG J, et al. The cementogenic differentiation of periodontal ligament cells via the activation of Wnt/β-catenin signalling pathway by Li+ ions released from bioactive scaffolds. Biomaterials, 2012, 33(27): 6370-6379.
[19] PAN CH, CHEN L, Wu RY, et al. Lithium-containing biomaterials inhibiting osteoclastogenesis of macrophages in vitro and osteolysis in vivo. Journal of Materials Chemistry B, 2018, 6: 8115-8126.
[20] ZHAI D, CHEN L, CHEN Y, et al. Lithium silicate-based bioceramics promoting chondrocyte maturation by immunomodulating M2 macrophage polarization. Biomaterials science, 2020, 8: 4521-4534.
[21] SOKOS D, EVERTS V, DE VRIES TJ. Role of periodontal ligament fibroblasts in osteoclastogenesis: a review. Journal of Periodontal Research, 2015, 50(2): 152-159.
[22] MCKEE MD, ADDISON WN, KAARTINEN MT. Hierarchies of extracellular matrix and mineral organization in bone of the craniofacial complex and skeleton. Cells Tissues Organs. 2005, 181: 176–188.
[23] MCKKEE MD, HOAC B, ADDISON WN, et al. Extracellular matrix mineralization in periodontal tissues: noncollagenous matrix proteins, enzymes, and relationship to hypophosphatasia and X-linked
hypophosphatemia. Periodontology 2000, 2013,63: 102-122.
[24] Liu XY, Ding CX, Chu PK. Mechanism of apatite formation on wollastonite coatings in simulated body fluids. Biomaterials, 2004,25 (10): 1755-1761.
[25] HENSTOCK JR, CANHAM, ANDERSON SI. Silicon: the evolution of its use in biomaterials. Acta Biomaterials, 2015, 11:17-26.
[26] ZHAI WY, LU HX, WU CT, et al. Stimulatory effects of the ionic products from Ca-Mg-Si bioceramics on both osteogenesis and angiogenesis in vitro. Acta Biomaterialia, 2013, 9(8): 8004-8014.
[27] WU CT, CHEN ZT, YI DL, et al. Multidirectional effects of Sr, Mg and Si-containing bioceramic coatings with high bonding strength on inflammation, osteoclastogenesis and osteogenesis. ACS Applied Materials & Interfaces, 2014, 6(6): 4264-4276.
[28] ZHU HY, ZHAI D, LIN CC, et al. 3D Plotting of highly uniform Sr5(PO4)2SiO4 bioceramic scaffolds for bone tissue engineering. Journal of Materials Chemistry B, 2016, 4: 6200-6212.
[29] STAHLI C, JAMES-BHASIN M, HOPPE A, et al. Effect of ion release from Cu-doped 45S5 Bioglass on 3D endothelial cell morphogenesis. Acta Biomaterialia,2015, 19: 15-22.
[30] SEPULVEDA P, JONES JR, HENCH LL. In vitro dissolution of melt-derived 45S5 and sol-gel derived 58S bioactive glasses. Journal of Biomedical Materials Research, 2002,61: 301-311.
[31] KAHLENBERG V, BRUNELLO E, HEJNY C, et al. Li2Ca2Si2O7: Structural, spectroscopic and computational studies on a sorosilicate. Journal of Solid State Chemistry, 2015, 225: 155-167.
[32] ZHANG JH, DUAN YH, LIA CX, A first-principles investigation of structural properties, electronic structures and optical properties of βand γ-LiAl (SiO3)2. Ceramics International,2017,43(16): 13948-13955.
[33] LARSSON L, DECKER AM, NIBALI L, et al. Regenerative Medicine for periodontal and peri-implant diseases. Journal of Dental Research, 2016, 95(3): 255-266.
[34] BUNPETCH V, ZHANG X, LI T, et al. Silicate-based bioceramic scaffolds for dual-lineage regeneration of osteochondral defect. Biomaterials, 2019, 192: 323-333.
声明:本文由 CERADIR 先进陶瓷在线平台的入驻企业/个人提供或自网络获取,文章内容仅代表作者本人,不代表本网站及 CERADIR 立场,本站不对文章内容真实性、准确性等负责,尤其不对文中产品有关功能性、效果等提供担保。本站提醒读者,文章仅供学习参考,不构成任何投资及应用建议。如需转载,请联系原作者。如涉及作品内容、版权和其它问题,请与我们联系,我们将在第一时间处理!本站拥有对此声明的最终解释权。









