摘要:氮化硅具有比氧化铝、氧化锆等牙科陶瓷修复材料更好的力学性能、化学稳定性和生物相容性,已经用于生物骨科修复。 近年来陆续有学者将氮化硅陶瓷引入到牙科修复领域,文章在介绍氮化硅陶瓷性能特点的基础上,综述了氮化硅陶瓷牙科种植体、氮化硅桩核冠及氮化硅饰面瓷的研究进展,并展望了氮化硅在牙科修复领域的未来研究方向。
关键词:氮化硅; 牙科修复; 牙科种植体; 桩核冠; 饰面瓷
0 引 言
牙科修复材料是指用于牙齿缺损修补、牙列缺失替代,从而使牙齿恢复解剖形态、功能和美观的材料。随着世界人口持续增长,医疗保健越来越受重视,对牙科修复材料的需求也日益增大。 牙科修复材料种类繁多,主要可分为金属、树脂和陶瓷三大类。 金属牙科修复材料至今已有 2 500 多年的历史,在牙科修复领域应用广泛,主要用来做充填材料和铸造冠、桥、种植体、义齿支架、基托等。 金属牙科修复材料(如钛合金)强度、硬度、耐磨性、耐久性等力学性能普遍优于树脂基材料,其韧性和可加工性也强于陶瓷材料,发展较为成熟,市场占有率大。 但是口腔中电解质环境复杂,不论是酸性溶液还是碱性溶液都会对金属产生一定的腐蚀作用。 因此金属植入口腔后会逐渐释放金属离子,使口腔中金属离子浓度逐渐升高,从而抑制细胞增殖分化以及细胞中某些蛋白和细胞因子的合成,甚至产生细胞毒性,诱导细胞凋亡[1]。 树脂基材料(如聚醚醚酮,PEEK)凭借色泽美观、粘接固位效果好以及可塑性良好等优点被广泛应用于牙体缺损修复领域。 但是其在充填过程中会发生固化收缩,而导致边缘缝隙增大,从而引起微渗漏和继发龋的发生。 陶瓷材料具有良好的色泽稳定性、耐磨性、生物相容性以及出色的光学性能和美观性,用于牙科修复领域已有 200 多年的时间。自 1886 年 Land 制作了第一个长石质全瓷冠以来,全瓷材料逐渐成为牙科修复材料的研究热点。 全瓷材料是指不含金属内冠的陶瓷修复体,可以分为三类:长石质瓷、玻璃陶瓷、多晶陶瓷。 长石质瓷机械性能较差,抗弯强度只有 60 ~70 MPa,现在只用作饰面瓷或贴面瓷。 玻璃陶瓷粘接强度不高,且由于氧化锆等其他材料的发展,临床应用逐渐减少。 多晶陶瓷主要为氧化铝和氧化锆,氧化铝陶瓷的力学性能远低于氧化锆,临床使用已逐渐被氧化锆取代[2]。 用于牙科修复材料的氧化锆为氧化钇稳定的四方多晶氧化锆,其具有优良的稳定性、耐磨性和生物相容性,抗弯强度可达 900 ~ 1 200 MPa,断裂韧性为 9 ~ 10 MPa·m1/2,是致密氧化铝陶瓷的 2 倍,玻璃陶瓷的 3 倍。 但氧化锆陶瓷材料在低温潮湿条件下会发生四方相-单斜相转变,导致体积膨胀,从而引起微裂纹和宏观裂纹的产生,即产生低温老化现象,临床应用中很容易导致人工植入体破折,不得不进行手术翻修。 这不但严重降低治疗的成功率,造成人力财力的浪费,而且还会对患者心理造成创伤。 此外,氧化锆在 X 射线成像时会出现放射状伪影,影响医生对病况的准确判断。
研究表明,氮化硅陶瓷与其他牙科陶瓷相比具有更好的生物相容性与化学稳定性,以及更高的强度和断裂韧性,其磨损率远远低于金属和其他陶瓷材料,同时密度比氧化铝、氧化锆和钛合金等更小[3],而且医用级氮化硅具有生物相容性,在体内稳定,并且不会影响 X 射线成像[4]。 还有研究表明,氮化硅陶瓷具有比其他生物材料更好的骨整合性能,对于有孔腔的氮化硅陶瓷,骨细胞能够向其孔内生长[5]。 因此,目前氮化硅陶瓷已经成功应用于骨科修复手术[6],骨科手术用氮化硅种植体实例如图 1 所示。 近年来研究人员探索氮化硅陶瓷应用于牙科种植体和全瓷冠等牙科修复领域上,并已取得初步的进展。 本文在全面总结氮化硅陶瓷性能的基础上,综述了氮化硅陶瓷在牙科修复领域的研究进展,并对未来的研究方向进行展望。

图 1 骨科手术用氮化硅种植体实例[6]
1 氮化硅陶瓷性能特点
1. 1 力学性能
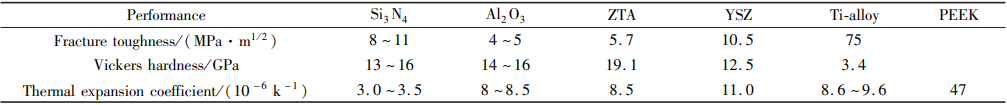
氮化硅陶瓷力学性能优异,具有较高的断裂强度、优良的耐磨性、韧性和抗热冲击性,在工业制造中得以广泛应用。 从表 1 中可以看出,氮化硅陶瓷密度为 3. 15 ~ 3. 26 g/cm³,只有氧化锆的一半,更接近于牙齿本身密度;弹性模量为 300 ~ 320 GPa,远高于钛合金(105 ~ 115 GPa),与氧化锆增韧氧化铝陶瓷( ZTA)相当(350 GPa);抗弯强度为 800 ~ 1 100 MPa,高于标准中冠桥修复的强度要求(500 MPa)[7],是氧化铝陶瓷的2 ~ 3 倍,接近氧化锆增韧氧化铝陶瓷和钇稳定氧化锆陶瓷(YSZ)的抗弯强度;断裂韧性为 8 ~ 11 MPa·m1/2,远超过牙科陶瓷的最高要求(5 MPa·m1/2),是氧化铝陶瓷的 2 倍,高于氧化锆增韧氧化铝陶瓷(5. 7 MPa·m1/2),与氧化锆陶瓷相当;维氏硬度在 13 ~ 16 GPa,与氧化铝陶瓷接近。
表 1 氮化硅与其他生物材料的性能比较[8]

1. 2 射线成像性能
氮化硅陶瓷能很好地阻挡射线透过,因此与氧化物陶瓷、金属等牙科修复材料相比,氮化硅陶瓷作为生物植入材料在 X 射线成像时更加清晰。 另外氮化硅陶瓷是无磁性的,在计算机断层扫描(CT)和核磁共振(MRI)成像时能清晰地显示种植体周围组织的整合,不会产生通常在钛合金植入体周围观察到的放射状伪影[9]。 这是理想牙科植入材料的一个重要特征。 Andreas 等[10] 将用氮化硅陶瓷制作的夹板和螺钉植入到小猪额骨,图 2( a)是植入 10 d 后的 X 射线图像,展示了氮化硅植入体的位置;图 2( b) 、( c)是 CT 扫描片,氮化硅植入体和周围的骨头能被很好地区分并且没有产生伪影;图 2( d)是 MRI 扫描片,显示没有引起成像畸变或产生伪影。

图 2 氮化硅实验板和螺钉植入原位的放射影像((d)中箭头为氮化硅夹板的位置,在 MRI 成像中未见)[10]
1. 3 抗菌性
抗菌性是骨科植入体的一个重要需求。 细菌感染会使植入体松动,阻碍骨愈合,从而导致骨科手术的失败。 Gorth 等[11]首次研究了 Si3N4 陶瓷、金属 Ti 和树脂材料聚醚醚酮(PEEK)对革兰氏阴性细菌的体外增殖作用。 结果表明,在 72 h 后,氮化硅陶瓷表面的细菌数量明显少于 Ti 和 PEEK,说明氮化硅植入体体外抗菌性优于 Ti 和 PEEK。 Pezzotti 等[12]在氮化硅陶瓷圆盘上培养牙龈卟啉单胞菌(PG),发现Si3N4盘表面和细菌代谢成分之间的化学相互作用导致 PG 裂解和代谢下降。 Bock 等[13] 测试了表皮葡萄球菌和大肠杆菌在PEEK、Ti 和 Si3N4盘上的增殖,结果表明,经过氮热、氧化、抛光处理以及未处理的氮化硅植入体表面细菌数量远少于 PEEK 和 Ti。 Webster 等[14]在大鼠颅盖内植入Si3N4、Ti 和 PEEK 后接种表皮葡萄球菌,3 个月后,PEEK、Ti 和 Si3N4表面的组织细菌计数百分比分别为 88% 、21% 和 0% 。 体外实验和体内实验研究结果均表明Si3N4 陶瓷具有优异的抗菌性。
1. 4 生物相容性
生物相容性是指生命体组织与非活性材料发生反应的一种性能,是生物材料研究中始终贯穿的主题。Kue[15]和 Sohrabi[16]等在抛光氮化硅陶瓷(RBSN 和 SRBSN)和聚苯乙烯(PS,设对照组)表面上培养成骨样细胞系(MG 63) 48 h,通过三氯醋酸(TCA)沉淀 3H-胸腺嘧啶放射性测试分析了 MG 63 细胞的增殖情况,结果表明(见图 3)抛光氮化硅陶瓷上 MG 63 细胞增殖数量(cpm)与抛光 PS 相比相差不大。 此外,骨钙素的产生也证实了成骨细胞的代谢正常[15],而且培养细胞中的炎症细胞因子(Il-1β,TNF-α)也没有增加[16]。 体外细胞实验证明氮化硅陶瓷是一种无毒的生物材料。
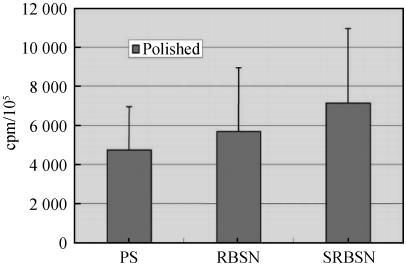
图 3 成骨样细胞在抛光氮化硅陶瓷和聚苯乙烯上的增殖情况[15]
Howlett 等[17]通过实验证明了氮化硅陶瓷的体内生物相容性,他们将氮化硅陶瓷植入兔股骨髓腔内 3个月后,种植体周围组织没有发生任何炎症反应。 另一项研究表明,植入兔胫骨内的 Si3N4 陶瓷和 Ti 种植体在术后 8 周内均未引起不良反应,骨愈合情况相似[18]。
1. 5 骨整合性能
骨整合性能是指在光学显微镜下,正常骨和植入体材料之间看不见软组织,两者直接接触,表现为材料和骨组织的连续性。 Neumann 等[19]在研究氮化硅陶瓷在骨中的生物相容性时发现,在小型猪模型中,用氮化硅陶瓷制作的额骨接骨板与螺钉有着令人满意的骨整合效果,说明氮化硅陶瓷是良好的面部骨外科生物材料。 Silva 等[18]在兔模型中发现 8 周可以实现胫骨与氮化硅陶瓷植入体的结合,由此计算出植入体与人类骨整合时间为 12 周。 如图 4 所示,通过扫描电镜(SEM)评估氮化硅陶瓷植入体周围的骨形成,发现植入体表面有新骨生长,并且有向骨髓腔延伸的趋势,新生骨中可见营养孔的形成,表明新生骨具有良好的质量[20]。 Webster 等[14]将 Si3N4 陶瓷、Ti 和 PEEK 3 种植入体分别植入大鼠颅骨模型中进行比较,3 个月后,3 种植入体表面新生骨的质量比分别为 23% 、9% 和 5% ,组织学切片也显示氮化硅陶瓷植入体周围形成了更好的新骨,这些实验都说明氮化硅陶瓷具有优异的骨整合性能。
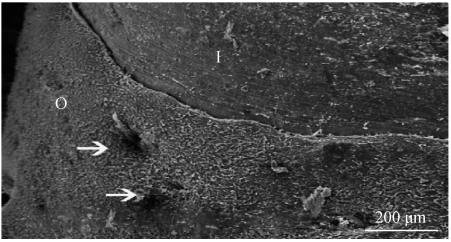
图 4 氮化硅植入物的扫描电镜(I)(白色箭头表示新骨中的营养因子,O 为新生骨)[20]
2 氮化硅牙科种植体
牙科种植是一种修复牙列缺失和缺损的有效手段,已广泛应用于临床[21]。 图 5 是牙科种植效果图,它采用人工材料(如金属、陶瓷等)制成种植体(一般类似牙根形态),经手术方法植入上下颌骨,待手术伤口愈合后在其上部安装牙冠。 选择牙科种植材料考虑的因素主要包括种植材料的抗旋转性、抗折断性以及耐磨性,如果种植材料抗旋转性较差,患者在咀嚼过程中容易出现牙齿松动的现象[22]。 此外相对于人体其他部位种植体材料,牙科种植体材料表面需要具有更高的生物活性。 生物活性主要指生物材料与活体骨产生化学键合的能力,较高的生物活性有利于加速获得骨整合效果。
图 5 牙科种植效果图
目前常用的牙科种植材料是 PEEK、钛合金等,PEEK 力学强度、生物相容性、粘接性能等较差,而钛合金制作工艺复杂、价格偏高、表面活性较低[23]、不耐磨损,易引起患者过敏反应和牙龈萎缩等问题而影响美观。氮化硅陶瓷以其优异的综合性能可以很大程度地避免以上问题,是一种极具前景的新型牙科种植材料。1999 年阮世红等[24]制作了氮化硅复合羟基磷灰石涂层种植体(Si3N4-HA)及单一氮化硅种植体(Si3N4),并采用骨组织形态计量学方法,从定量、动态的角度比较了两种种植体对周围骨组织的影响。 将 Si3N4-HA、Si3N4 植入 Beagle 犬双侧股骨干,分别观察 1、3、6、12 个月后取出的股骨,进行骨形态学和动力学参数的测量,观察种植体-骨界面的骨代谢情况。 结果表明,实验动物的种植区伤口皆愈合良好,组织无炎症、肿胀。氮化硅植入 6 个月时,种植区的骨基质生成和矿化速度仍然较快,成骨仍较活跃,种植体和骨的结合还在加强。 继续测试氮化硅复合羟基磷灰石涂层种植体和单一氮化硅种植体与骨界面的剪切强度[25],结果表明,早期有涂层的种植体其界面结合强度高于无涂层样品,6 个月时两种种植体与骨界面的剪切强度无显著性差异,Si3N4-骨界面的结合强度略高,这一结果与骨计量学分析结果一致。 羟基磷灰石(HA)涂层种植体稳定性高,但 HA 涂层能否保持长期稳定,特别是在咀嚼压力下能否维持其原有特性,尚须进一步研究。 同年,徐连来等[26]采用等离子喷涂技术在氮化硅陶瓷基底上喷涂羟基石灰石涂层,处理后的氮化硅陶瓷表面呈熔合状态,HA 颗粒较大且大小颗粒表面熔合相嵌,且有明显的贯通孔道,这有利于骨组织的生长。 2005 年阮世红等[27]使用等离子喷涂技术制备了氟磷灰石(FA)涂层氮化硅陶瓷种植体,将其植入动物体内并计算了骨动力学参数。 扫描电镜显示种植体涂层与骨接触的部位未见沟隙存在,FA 涂层种植体与宿主骨形成骨性结合,这是目前公认的比较理想的结合类型。 该结果连同早期报道的 HA 涂层氮化硅种植体的结果都说明在氮化硅陶瓷种植体涂覆生物活性陶瓷涂层后其早期成骨更为活跃,结合强度也更大。
3 氮化硅桩核冠
桩核冠是修复大面积牙体缺损的一种常用的修复方法。 大面积牙体缺损是指患牙冠部硬组织大部缺失,甚至累及牙根。 由于剩余的牙体组织量少,无法单独使用全冠获得良好固位。 为了增加固位,将修复体的一部分插入根管内,这部分修复体被称为桩。 早期的桩和冠是一体的,称作桩冠;目前已对使用的桩冠进行了改良,如图 6 所示,桩和外面的全冠是分开制作的,各自独立,核是固定于桩之上,与牙冠剩余的牙体硬组织一起形成最终的全冠预备体,为全冠提供固位,故称作桩核冠。
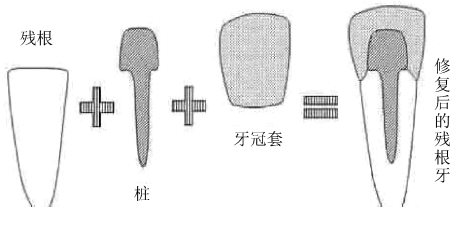
图 6 桩核冠修复示意图
金属铸桩核冠会因为微渗漏的存在,发生不同程度的氧化,长时间使用后金属离子析出,对牙龈牙体产生颜色渗入,从而影响美观,而全瓷桩核冠不存在氧化的问题,不会对牙龈及牙体的基本色泽产生影响。Wasanapiarnpong 等[28-29]以 Y2O3 、SiO2 、MgO(质量比为 3 ∶ 3 ∶ 5)作为烧结助剂,在 1 650 ℃氮气氛围下无压烧结制备了氮化硅陶瓷并将其用作桩核冠,其杨氏模量和维氏硬度值分别为 300 GPa 和 18. 4 GPa,抗弯强度和断裂韧性分别为 980 MPa 和 6. 6 MPa·m1/2。 细胞毒性检测(MTT)结果表明,氮化硅无毒,可以用作牙科材料。 Wang 等[30]通过凝胶注模成型和无压烧结制备出多孔氮化硅陶瓷,然后对其进行聚甲基丙烯酸甲酯(PMMA)渗透,固化后得到聚合物渗透 Si3N4 复合材料( PISNC),该材料的孔隙率和抗弯强度分别为1. 94% ~ 2. 28% 和 273 ~ 385. 3 MPa,其硬度与弹性模量分别为 2. 4 GPa 和 56. 1 GPa,与牙釉质相似,咬合时不会对其他牙齿造成伤害。 此外,PISNC 还表现出优异的生物相容性,图 7 对比了 PISNC、PMMA 和 Si3N4 陶瓷表面培育人体牙龈纤维细胞(HGfs) 的情况。 由图可见,1 h后,PMMA 表面 HGfs 的丝状伪足很少,而PSN60(用固体质量含量为60% 的悬浮液制备的 PISNC)和 Si3N4 陶瓷表面 HGfs 的丝状伪足或片状伪足较多且清晰,且随着培养时间的增加,PSN60 和 Si3N4 陶瓷表面 HGfs 的增殖数量更多,说明 PISNC 和 Si3N4陶瓷对 HGfs 的粘附、扩散、增殖有促进作用,有利于其在牙科修复材料中的应用。
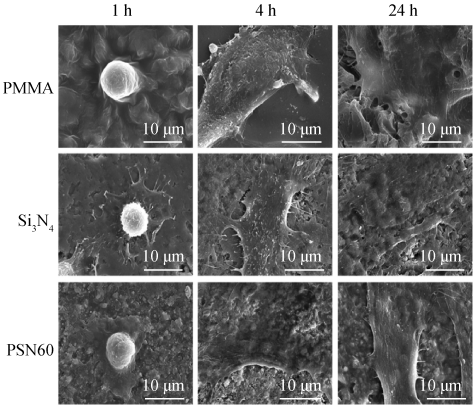
图 7 在 PISNC、Si3N4 及 PMMA 表面培养不同时间的人体牙龈纤维细胞的 SEM 照片[30]
4 氮化硅饰面瓷
20 世纪60 年代问世的瓷熔附金属(PFM,Porcelain Fused to Metal)技术对于牙科修复材料的发展而言是一次划时代的革命,它将低熔瓷熔附于金属表面制成修复体[31]。 这种熔附于金属表面的瓷称作饰面瓷,其主要作用是为牙冠提供美观和咬合功能。 饰面瓷早期主要用于金属基底,现在多用于全瓷冠修复体。 饰面瓷要求具有与天然牙相近的颜色、透明度、力学性能以及良好的生物相容性,同时其热膨胀系数要低于基底材料的 10% ,以便在二者界面上产生一定的压应力,利于饰面瓷和基底的结合[32]。 目前商售饰面瓷主要与氧化锆和金属等基底配套使用,热膨胀系数在 10 ×10-6/ ℃左右,与氮化硅的热膨胀系数(3. 0 ~ 3. 5 × 10-6/ ℃)严重不匹配,无法用于氮化硅陶瓷。 此外,氮化硅陶瓷的颜色通常为黑色,与牙齿颜色相差较大,不能满足美观的要求,所以更加迫切需要研发与氮化硅陶瓷相匹配的饰面瓷,但目前这方面的研究报道有限。
Wananuruksawong 等[33]制备了涂覆于氮化硅陶瓷的硼酸盐饰面瓷,在硼酸盐玻璃粉中添加 5% (质量分数)的氧化锆粉,混合均匀后加入 30% (质量分数) 的聚乙烯醇溶液,涂覆在氮化硅陶瓷表面,然后在1 100 ~ 1 200 ℃下烧结。制得的饰面瓷呈白色且半透明, 起到很好的美观效果; 其热膨胀系数为3. 98 × 10-6/ ℃ ,与作者自制氮化硅陶瓷基底的热膨胀系数(3. 48 × 10-6/ ℃ )接近,可以粘附在氮化硅陶瓷上而不会开裂、剥落;饰面瓷硬度为 4 GPa,与人类牙齿的硬度(3 ~ 5 GPa)相当,咬合时不会对天然牙造成损伤。 之后的细胞毒性测试表明,该硼酸盐饰面瓷无毒,且与人的牙龈和牙周组织生物相容[29],可以安全应用于牙科修复。 但该研究只对这种饰面瓷的热膨胀系数、硬度、色度、细胞毒性进行了探究,忽略了力学性能、化学稳定性和放射性等。 此外,该硼酸盐饰面瓷的热膨胀系数仍大于氮化硅基底的热膨胀系数,这对两者的结合强度也会产生不利影响。
5 结论与展望
氮化硅陶瓷具有良好的力学性能、射线成像性能、抗菌性、生物相容性和骨整合性能,已成功应用于骨科修复。 近年来,研究人员探索将其用于牙科种植体、桩核冠,已取得了可喜的进展,展现出氮化硅陶瓷在牙科修复材料领域良好的应用前景。 但总体上目前的研究才刚刚起步,未来还需从以下方面开展进一步研究:
(1)多孔氮化硅陶瓷用作牙科种植体可以获得更好的固定与骨整合效果,但是其强度较低,有待进一步提高,同时还需优化隙结构;
(2)致密氮化硅陶瓷也可用作牙科种植体,但是需要结合更多的动物实验来研究;
(3)致密氮化硅陶瓷用作牙冠时硬度较高、加工困难、烧结温度高,故成本较高,可以通过优化工艺、改善烧结助剂进一步降低氮化硅的烧结温度,还可以通过陶瓷 3D 打印技术解决陶瓷的成型、加工问题,降低氮化硅的加工成本;
(4)氮化硅本身颜色为灰色或灰黑色,透光性较差,不满足美观要求,且目前尚无与氮化硅陶瓷热膨胀系数相匹配的饰面瓷,相关研究也较少,需要加强氮化硅陶瓷饰面瓷的开发及其与氮化硅陶瓷界面结合的研究。
可以预见,随着对氮化硅陶瓷牙科修复材料重视程度的日益提高和相关研究的不断深入,上述问题将会得到有效解决,氮化硅陶瓷将会在牙科修复领域中得到广泛应用。
参 考 文 献
[1] EGUSA H, KO N, SHIMAZU T, et al. Suspected association of an allergic reaction with titanium dental implants: a clinical report[ J]. The Journal of Prosthetic Dentistry, 2008, 100(5): 344-347.
[2] GRACIS S, THOMPSON V P, FERENCZ J L, et al. A new classification system for all-ceramic and ceramic-like restorative materials[J]. The International Journal of Prosthodontics, 2015, 28(3): 227-235.
[3] MAZZOCCHI M, BELLOSI A. On the possibility of silicon nitride as a ceramic for structural orthopaedic implants. Part I: processing, microstructure, mechanical properties, cytotoxicity[J]. Journal of Materials Science: Materials in Medicine, 2008, 19(8): 2881-2887.
[4] CAPPI B, NEUSS S, SALBER J, et al. Cytocompatibility of high strength non-oxide ceramics[J]. Journal of Biomedical Materials Research Part A, 2010, 93A(1): 67-76.
[5] ANDERSON M C, OLSEN R. Bone ingrowth into porous silicon nitride[J]. Journal of Biomedical Materials Research Part A, 2010, 92A(4):1598-1605.
[6] RAHAMAN M N, YAO A, BAL B S, et al. Ceramics for prosthetic hip and knee joint replacement[ J]. Journal of the American Ceramic Society, 2007, 90(7): 1965-1988.
[7] Zhejiang Insititute of Stardardization. Dentistry-ceramic materials: ISO 6872—2015[S]. Switzerland: International Organization for Stardardization,2015.
[8] MAZZOCCHI M, BELLOSI A. On the possibility of silicon nitride as a ceramic for structural orthopaedic implants. Part I: processing, microstructure, mechanical properties, cytotoxicity[J]. Journal of Materials Science: Materials in Medicine, 2008, 19(8): 2881-2887.
[9] BAL B S, RAHAMAN M N. Orthopedic applications of silicon nitride ceramics[J]. Acta Biomater, 2012, 8(8): 2889-2898.
[10] ANDREAS N, CLAUS U, CHRISTOPH W, et al. Prototype of a silicon nitride ceramic-based miniplate osteofixation system for the midface[J]. Otolaryngology—Head and Neck Surgery: Official Journal of American Academy of Otolaryngology-Head and Neck Surgery, 2006, 134(6): 923-930.
[11] BAL S, GORTH D, PUCKETT S, et al. Decreased bacteria activity on Si3N4 surfaces compared with PEEK or titanium[J]. International Journal of Nanomedicine, 2012: 4829.
[12] PEZZOTTI G, BOCK R M, MCENTIRE B J, et al. Silicon nitride bioceramics induce chemically driven lysis in porphyromonas gingivalis[ J]. Langmuir, 2016, 32(12): 3024-3035.
[13] BOCK R M, JONES E N, RAY D A, et al. Bacteriostatic behavior of surface modulated silicon nitride in comparison to polyetheretherketone and titanium[J]. Journal of Biomedical Materials Research Part A, 2017, 105(5): 1521-1534.
[14] WEBSTER T J, PATEL A A, RAHAMAN M N, et al. Anti-infective and osteointegration properties of silicon nitride, poly(ether ether ketone), and titanium implants[J]. Acta Biomaterialia, 2012, 8(12): 4447-4454.
[15] KUE R, SOHRABI A, NAGLE D, et al. Enhanced proliferation and osteocalcin production by human osteoblast-like MG63 cells on silicon nitride ceramic discs[J]. Biomaterials, 1999, 20(13): 1195-1201.
[16] SOHRABI A, HOLLAND C, KUE R, et al. Proinflammatory cytokine expression of IL-1β and TNF-α by human osteoblast-like MG-63 cells upon exposure to silicon nitride in vitro[J]. Journal of Biomedical Materials Research, 2000, 50(1): 43-49.
[17] HOWLETT C R, MCCARTNEY E, CHING W. The effect of silicon nitride ceramic on rabbit skeletal cells and tissue[J]. Clinical Orthopaedics and Related Research, 1989(244): 293-304.
[18] GUEDES E SILVA C C, KÖNIG B J, CARBONARI M J, et al. Tissue response around silicon nitride implants in rabbits[ J]. Journal of Biomedical Materials Research Part A, 2008, 84A(2): 337-343.
[19] NEUMANN A, RESKE T, HELD M, et al. Comparative investigation of the biocompatibility of various silicon nitride ceramic qualities in vitro[J].Journal of Materials Science: Materials in Medicine, 2004, 15(10): 1135-1140.
[20] GUEDES E SILVA C C, KÖNIG B J, CARBONARI M J J, et al. Bone growth around silicon nitride implants—An evaluation by scanning electron microscopy[J]. Materials Characterization, 2008, 59(9): 1339-1341.
[21] KIRIAKOU J, PANDIS N, FLEMING P S, et al. Reporting quality of systematic review abstracts in leading oral implantology journals[ J]. Journal of Dentistry, 2013, 41(12): 1181-1187.
[22] 黄宝鑫,陈卓凡. 骨组织替代材料在口腔种植临床与基础的研究进展[J]. 中国口腔种植学杂志,2007,12(4):190-195.
[23] 许 标,姜云海,朱 渊. 医用钛合金的研究现状及发展[J]. 科技创新导报,2015,12(6):201-202 + 204.
[24] 阮世红,李松岭,史书俊,等. 氮化硅复合骨内种植体的骨计量学研究[J]. 中华口腔医学杂志,1999,34(4):3-5.
[25] 阮世红,武 剑,刘 杰. 氮化硅复合种植体-骨界面的剪切强度[J]. 实用口腔医学杂志,2000,16(5):378-379.
[26] 徐连来,史书俊,范景林,等. 等离子喷涂高强陶瓷复合骨内种植体实验研究[J]. 硅酸盐通报,2000,19(6):50-53.
[27] 阮世红,武 剑,董旭东. 氟磷灰石涂层氮化硅种植体的动物实验研究[J]. 中国口腔种植学杂志,2005,10(1):5-8.
[28] WASANAPIARNPONG T, CHERDTHAM N, PADIPATVUTHIKUL P, et al. Fabrication of dental ceramics from silicon nitride core with borosilicate glass veneer[J]. Advanced Materials Research, 2012, 506: 493-496.
[29] WANANURUKSAWONG R, WASANAPIARNPONG T, DHANESUAN N, et al. Microhardness and biocompatibility of silicon nitride ceramic developed for dental applications[J]. Materials Sciences and Applications, 2014, 5(14): 1034-1039.
[30] WANG F, GUO J S, LI K, et al. High strength polymer/ silicon nitride composites for dental restorations[J]. Dental Materials, 2019, 35(9):1254-1263.
[31] KELLY J R. Ceramics in restorative and prosthetic dentistry[J]. Annual Review of Materials Science, 1997, 27(1): 443-468.
[32] COFFEY J P, ANUSAVICE K J, DEHOFF P H, et al. Influence of contraction mismatch and cooling rate on flexural failure of PFM systems[J]. Journal of Dental Research, 1988, 67(1): 61-65.
[33] WANANURUKSAWONG R, JINAWATH S, PADIPATVUTHIKUL P, et al. Fabrication of silicon nitride dental core ceramics with borosilicate veneering material[J]. IOP Conference Series: Materials Science and Engineering, 2011, 18(19): 192010.
声明:本文由 CERADIR 先进陶瓷在线平台的入驻企业/个人提供或自网络获取,文章内容仅代表作者本人,不代表本网站及 CERADIR 立场,本站不对文章内容真实性、准确性等负责,尤其不对文中产品有关功能性、效果等提供担保。本站提醒读者,文章仅供学习参考,不构成任何投资及应用建议。如需转载,请联系原作者。如涉及作品内容、版权和其它问题,请与我们联系,我们将在第一时间处理!本站拥有对此声明的最终解释权。









